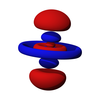
δ轨道

在化学与原子物理学中,δ轨域(英语:δ orbital, delta orbital)是一种分子轨域。是形成δ键后所产生的分子轨域。δ轨域是一种由d轨域四重交叠而成所形成的新轨域。
δ轨域会出现在已经形成δ键的化合物中,而已经形成δ键的化合物多半是有机金属化合物中,尤其是钌、钼和铼所形成的化合物,因此,这些化合物中皆可以找到δ轨域。
除了δ轨域外,还有一些轨域也是面对面重叠后所形成的分子轨域,例如:φ轨域、γ轨域。
结构[编辑]

δ轨域是一种由轨域面对面重叠后所形成的分子轨域,主要是由d轨域所形成,较常是由两个原子的dxy轨域或 dx2-y2轨域发生交互作用而形成。由于这些分子轨域涉及低能量d轨域,他们被视为过渡金属配合物。
δ轨域的电子出现概率在原子附近与d轨域相同,然后离原子较远的地方开始减少,直到δ键正中央时降为0,然后到靠近另外一个原子之处又升高,在另外一个原子支出的电子出现概率形状也与d轨域相同,中间电子出现概率降为0之处称为波节面,除了两原子中间有波节面外,每个叶中也可以有波节。
δ键[编辑]
参考文献[编辑]
- 曾国辉《原子结构》建宏出版社 台北市 1999 ISBN 957-724-801-2
- 曾国辉《化学键》建宏出版社 台北市 1999 ISBN 957-724-802-0
参见[编辑]
| |||||||||||||||||||||||||||||||