三氯化釹
| 三氯化釹 | |||
|---|---|---|---|
| |||
| 別名 | 氯化釹 Neodymium trichloride | ||
| 識別 | |||
| CAS號 | 10024-93-8 13477-89-9(六水合物) | ||
| PubChem | 66204 | ||
| ChemSpider | 59589 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ATINCSYRHURBSP-DFZHHIFOAM | ||
| 性質 | |||
| 化學式 | NdCl3, NdCl3·6H2O(水合物) | ||
| 莫耳質量 | 250.598 g·mol⁻¹ | ||
| 外觀 | 紫色易潮解粉末 | ||
| 密度 | 4.13 g/cm3(水合物2.282) | ||
| 熔點 | 758 °C(1031 K) | ||
| 沸點 | 1600 °C(1873 K) | ||
| 溶解性(水) | 0.967 kg/L at 13 °C | ||
| 溶解性(乙醇) | 0.445 kg/L | ||
| 結構 | |||
| 晶體結構 | 六方晶系(UCl3結構),hP8 | ||
| 空間群 | P63/m, No. 176 | ||
| 配位幾何 | 三帽三稜柱配位構型 (九配位) | ||
| 危險性 | |||
| MSDS | External MSDS | ||
| 歐盟編號 | Not listed | ||
| 相關物質 | |||
| 其他陰離子 | 三溴化釹 三氧化二釹 | ||
| 其他陽離子 | LaCl3, SmCl3, PrCl3, EuCl3, CeCl3, GdCl3, TbCl3, TbCl3 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
三氯化釹,也稱氯化釹,是釹和氯兩種元素組成的化合物,化學式為NdCl3。無水三氯化釹是為淡紫色固體,置於空氣中會迅速吸水,變成紫色的水合物NdCl3·6H2O。三氯化釹是通過一種複雜的多級提取工藝從礦物獨居石和氟碳鈰礦里提煉出來的。這種氯化物有多種重要應用,比如生產金屬釹和金屬釹基雷射和光導纖維的化學中間體,其他應用包括有機合成和分解廢水污染物的催化劑、鋁及其合金的腐蝕防護劑、有機分子(DNA)螢光標記物。
外觀[編輯]

NdCl3是一種淡紫色易潮解固體,吸收水蒸汽後變為紫色。生成的水合物像其他釹鹽一樣,在螢光下呈現不同的顏色,對於氯鹽,呈現淺黃色(見圖)[1]。顏色的變化最可能的成因是Nd3+通過電荷轉移躍遷變成Nd2+,Nd3+的橙光吸收帶減弱,Nd2+的綠光吸收增強,產生了黃光[2][3]。
結構[編輯]
固體[編輯]
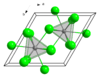
無水NdCl3為Nd九配位三帽三稜柱配位構型,具有類似UCl3的六方晶系晶體結構。六方晶繫結構常見於鑭系元素和錒系元素的鹵化物,如LaCl3、LaBr3、SmCl3、PrCl3、EuCl3、CeCl3、CeBr3、GdCl3、AmCl3和TbCl3,但是YbCl3和LuCl3例外。[4]
溶液[編輯]
三氯化釹在溶液中的結構與溶劑密切相關,在水溶液中,主要成分是[Nd(H2O)8]3+,大部分稀土元素的氯化物和溴化物都有類似情況。甲醇溶液中的主要成分是[NdCl2(CH3OH)6]+,在鹽酸溶液中,成分是[NdCl(H2O)7]2+。各種情況下,釹均為八面體配位[5]。
性質[編輯]
NdCl3為軟順磁性固體,奈爾溫度低至0.5 K,即溫度低於0.5 K時,NdCl3變為鐵磁性固體[6]。NdCl3電導率為 240 S/m,熱容為~100 J/(mol·K)[7]。 NdCl3易溶於水和乙醇,不易溶於氯仿和乙醚。 NdCl3和金屬Nd加熱到650 °C,發生氧化還原反應,生成NdCl2:[8]
- 2 NdCl3 + Nd → 3 NdCl2
- NdCl3 + H2O → NdOCl + 2 HCl
- 2 NdCl3 + SiO2 → 2 NdOCl + SiCl4
NdCl3與硫化氫在約1100 °C的高溫下反應,生成硫化釹Nd2S3:
- 2 NdCl3 + 3 H2S → 2 Nd2S3 + 6 HCl
NdCl3在高溫下與氨氣或磷化氫反應,分別生成氮化釹NdN和磷化釹NdP:
- NdCl3 + NH3 → NdN + 3 HCl
- NdCl3 + PH3 → NdP + 3 HCl
- NdCl3 + 3 HF → NdF3 + 3 HCl
製備[編輯]

NdCl3可以從礦物獨居石和氟碳鈰礦製得。製備過程非常複雜,因為地殼中釹元素的豐度很低,約38mg/kg,並且釹元素很難從鑭系元素分離出來。由於礦物中釹元素比其他鑭系元素含量高,質量分數高達16%,在鑭系元素中居第三位,僅列鈰和鑭之後,因此製得釹的過程比其他鑭系元素來得容易[10]。NdCl3工業製備過程簡介如下:
將礦石磨碎之後,用熱的濃硫酸處理,生成水溶性的稀土硫酸鹽。酸性濾液用氫氧化鈉部分中和至pH值為3-4。釷元素以氫氧化物的形式沉澱出來並去除,剩餘的溶液以草酸銨處理,將稀土轉化成不溶的草酸鹽。退火之後,草酸鹽變成氧化物。將氧化物溶於硝酸,這樣可除去一些主要成分鈰,因為鈰的氧化物(主要為二氧化鈰)不溶於硝酸。通過離子交換法,氧化釹從其他稀土元素的氧化物分離出來。此過程中,稀土離子與樹脂中的氫離子、銨離子和銅離子交換,吸附到樹脂上。然後用合適的絡合劑,如檸檬酸銨和次氮基三乙酸鹽,將稀土離子選擇性地洗出[9]。
以上過程正常情況下得到產物Nd2O3,這一氧化物難以轉化成技術上所需的金屬釹。因此,用鹽酸或氯化銨處理這一氧化物,生成較不穩定的NdCl3:[9]
- Nd2O3 + 6 NH4Cl → 2 NdCl3 + 3 H2O + 6 NH3
產物NdCl3迅速吸水,變成可以穩定儲存的水合物NdCl3·6H2O,並且必要時可以變回NdCl3。簡單加熱NdCl3·6H2O不能得到NdCl3,因為會發生水解,生成Nd2O3[11]。因此,需要特別的方法得到無水NdCl3,一個方法是在高真空環境下將NdCl3·6H2O與4-6當量的氯化銨緩慢升溫到400 °C,另一方法是,與過量氯化亞碸一起加熱數個小時[4][12][13][14]。
NdCl3還可以由金屬釹與鹽酸或氯反應製備,但是金屬釹成本很高,因此這一方法不夠經濟,只能用於實驗室研究。製備完成之後,產物在高真空高溫下升華提純。[4][15][16]
應用[編輯]
製備金屬釹[編輯]

氯化釹是製備金屬釹的起始化合物。在真空或氬氣氣氛下,NdCl3與氯化銨或氟化銨和氫氟酸一起加熱,或與鹼金屬或鹼土金屬加熱到300-400°C,可得金屬釹
- NdCl3 + 3 Li → Nd + 3 LiCl
另一個製備方法是在約700°C的溫度下,電解無水NdCl3與NaCl或KCl組成的熔融混合物[17]。
雷射和光纖放大器[編輯]
NdCl3本身冷發光性能不強[18],但是它可以為Nd:YAG雷射和摻釹光纖放大器等各種發光材料提供Nd3+離子。Nd-YAG雷射器發射波長為1.064微米的紅外光,是最常見的固體雷射器(即工作物質為固體的雷射器)。這些發光材料中用NdCl3而不是金屬釹或其氧化物的原因是,加工光纖時化學氣相沉積工藝中NdCl3易於沉積,化學氣相沉積是光纖生長中廣泛使用的工藝[19]。
三氯化釹不僅用作傳統的石英光纖的摻雜劑,還用作塑料光纖(聚醯亞胺、聚乙烯等)的摻雜劑[20]。NdCl3還用作紅外有機發光二極體的添加劑[21][22]。除此之外,摻釹薄膜不僅能用作LED,還能做濾光片,改善LED的發射光譜[23]。
利用NdCl3(和其他稀土鹽)在各種溶劑中的溶解性,可製造一種新型的稀土雷射器,這種雷射器的工作物質不是固體而是液體,液體中的Nd3+離子可由以下反應製備:
- SnCl4 + 2 SeOCl2 → SnCl62− + 2 SeOCl+
- SbCl5 + SeOCl2 → SbCl62− + SeOCl+
- 3 SeOCl+ + NdCl3 → Nd3+(solv) + 3 SeOCl2,
其中,Nd3+其實是溶劑化離子,被幾個氧氯化硒包圍的球,即[Nd(SeOCl2)m]3+。這一方法製備的液體雷射材料同樣發生波長為1.064微米的紅外光,具有高增益和單色性強等性質,性質更類似晶體釹雷射器的特點,而非玻璃釹雷射器的特點。這樣的液體雷射器的量子效率是傳統Nd:YAG雷射器的0.75倍[21]。
催化劑[編輯]
NdCl3與其他有機物如三乙基鋁或2-丙醇等結合可用作齊格勒-納塔催化劑,加快各種二烯烴的聚合反應,產物包括通用合成橡膠,如聚丁烯、順丁橡膠和聚異戊二烯[11][24][25]。
三氯化釹還用於二氧化鈦改性。二氧化鈦是最常見的無機光催化劑,可用於催化分解廢水污染物如苯酚和各種染料。二氧化鈦的催化反應必須用紫外光觸發。而如果二氧化鈦修飾上NdCl3,在日光等可見光下也可以有催化功能。NdCl3改性的二氧化鈦可通過化學共沉澱-膠溶方法從TiCl4和NdCl3混合物的水溶液製備。這一工藝在商業上用在光催化自清潔塗料的1000升規模的反應器上。[26][27]
防腐蝕[編輯]
據文獻報導,鋁或鋁合金表面塗上三氯化釹,放置於NaCl溶液中兩個月,不見一點腐蝕痕跡。這種防腐塗層可以將鋁或鋁合金浸沒於NdCl3水溶液數周製得,或者在NdCl3水溶液中電鍍製得。與鉻等傳統阻蝕劑相比,NdCl3和其他稀土鹽對環境更友好,對人類和動物毒性更低。[28][29]
NdCl3在鋁合金表面生成了不溶的氫氧化釹,因此對鋁合金有保護作用。NdCl3作為一種氯化物,本身是一種腐蝕劑,有時用以做陶瓷材料腐蝕試驗。[30]
標記有機分子[編輯]
包括釹在內的鑭系元素有強的發光性能,廣泛用作螢光標記物。DNA等有機分子被NdCl3標記後,非常易於在螢光顯微鏡下示蹤[21]。
毒性[編輯]
三氯化釹對人和動物沒有明顯毒性,其毒性與食鹽相差不大。三氯化釹對動物的半數致死量LD50 (能殺死一半試驗樣品的劑量)為3.7 g每千克體重(小鼠口服),或0.15 g/kg(兔,靜脈注射)。連續24小時接觸500毫克,對皮膚有輕微刺激(兔眼刺激試驗)。[31][32]LD50大於2 g/kg可認為無毒[33]。
參見[編輯]
參考文獻[編輯]
- ^ Michael O'Donoghue, Robert Webster. Gems. Butterworth-Heinemann. 2006: 523. ISBN 0-7506-5856-8.
- ^ Yamana, Hajimu; Park, Byung Gi; Shirai, Osamu; Fujii, Toshiyuki; Uehara, Akihiro; Moriyama, Hirotake. Electrochemically produced divalent neodymium in chloride melt. Journal of Alloys and Compounds. 2006,. 408–412: 66. doi:10.1016/j.jallcom.2005.04.104.
- ^ Terakado, O; El Abedin, Sherif Zein; Endres, Frank; Nattland, Detlef; Freyland, Werner. Intervalence charge transfer in neodymium–neodymium chloride melts: spectroscopic and electrical conductivity study. Journal of Non-Crystalline Solids. 2002,. 312–314: 459. doi:10.1016/S0022-3093(02)01714-3.
- ^ 4.0 4.1 4.2 F. T. Edelmann, P. Poremba. W. A. Herrmann , 編. Synthetic Methods of Organometallic and Inorganic Chemistry Vol. 6. Stuttgart: Georg Thieme Verlag. 1997.
- ^ Steele, Marcus L.; Wertz, David L. Solvent effects on the coordination of neodymium(3+) ions in concentrated neodymium trichloride solutions. Inorganic Chemistry. 1977, 16 (5): 1225. doi:10.1021/ic50171a050.
- ^ Skjeltorp, A. Analysis of magnetothermal parameters in NdCl3. Physica B+C. 1977, 86–88: 1295. doi:10.1016/0378-4363(77)90888-9.
- ^ R. T. Carlin. Molten Salts. The Electrochemical Society. 1996: 447. ISBN 1-56677-159-5.
- ^ Gerd Meyer, Lester R. Morss. Synthesis of lanthanide and actinide compounds. Springer. 1991: 161. ISBN 0-7923-1018-7.
- ^ 9.0 9.1 9.2 Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. McGraw-Hill. 2003: 444–446 [2009-06-06]. ISBN 0-07-049439-8.
- ^ John Emsley. Nature's building blocks: an A-Z guide to the elements. Oxford University Press. 2003: 268–270. ISBN 0-19-850340-7.
- ^ 11.0 11.1 O. Nuyken, R. Anwander. Neodymium based Ziegler catalysts. Springer. 2006: 15. ISBN 3-540-34809-3.
- ^ M. D. Taylor, P. C. Carter. Preparation of anhydrous lanthanide halides, especially iodides. J. Inorg. Nucl. Chem. 1962, 24 (4): 387. doi:10.1016/0022-1902(62)80034-7.
- ^ J. Kutscher, A. Schneider. Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden. Inorg. Nucl. Chem. Lett. 1971, 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- ^ J. H. Freeman, M. L. Smith. The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride. J. Inorg. Nucl. Chem. 1958, 7 (3): 224. doi:10.1016/0022-1902(58)80073-1.
- ^ L. F. Druding, J. D. Corbett. Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide. J. Am. Chem. Soc. 1961, 83 (11): 2462. doi:10.1021/ja01472a010.
- ^ J. D. Corbett. Rev. Chim. Minerale. 1973, 10: 239. 缺少或
|title=為空 (幫助) - ^ C. K. Gupta, Nagaiyar Krishnamurthy. Extractive metallurgy of rare earths. CRC Press. 2004: 276. ISBN 0-415-33340-7.
- ^ B. Henderson, Ralph H. Bartram. Crystal field engineering of solid state laser materials. Cambridge University Press. 2000: 211. ISBN 0-521-59349-2.
- ^ Emil Wolf. Progress in Optics. Elsevier. 1993: 49. ISBN 0-444-81592-9.
- ^ Wong, W; Liu, K; Chan, K; Pun, E. Polymer devices for photonic applications. Journal of Crystal Growth. 2006, 288: 100. doi:10.1016/j.jcrysgro.2005.12.017.
- ^ 21.0 21.1 21.2 Comby, S; Bunzli, J. Handbook on the Physics and Chemistry of Rare Earths Volume 37. Handbook on the Physics and Chemistry of Rare Earths 37: 217. 2007. ISBN 978-0-444-52144-6. doi:10.1016/S0168-1273(07)37035-9.
|chapter=被忽略 (幫助) - ^ Oriordan, A; Vandeun, R; Mairiaux, E; Moynihan, S; Fias, P; Nockemann, P; Binnemans, K; Redmond, G. Synthesis of a neodymium-quinolate complex for near-infrared electroluminescence applications. Thin Solid Films. 2008, 516 (15): 5098. doi:10.1016/j.tsf.2007.11.112.
- ^ Cho, Y.; Choi, Y. K.; Sohn, S. H. Optical properties of neodymium-containing polymethylmethacrylate films for the organic light emitting diode color filter. Applied Physics Letters. 2006, 89 (5): 051102. doi:10.1063/1.2244042.
- ^ Marina, N; Monakov, Y; Sabirov, Z; Tolstikov, G. Lanthanide compounds—Catalysts of stereospecific polymerization of diene monomers. Review☆. Polymer Science U S S R. 1991, 33 (3): 387. doi:10.1016/0032-3950(91)90237-K.
- ^ C. Wang. In situ cyclization modification in polymerization of butadiene by rare earth coordination catalyst. Materials Chemistry and Physics. 200, 89: 116. doi:10.1016/j.matchemphys.2004.08.038.
- ^ Xie, Y. Photocatalysis of neodymium ion modified TiO2 sol under visible light irradiation. Applied Surface Science. 2004, 221: 17. doi:10.1016/S0169-4332(03)00945-0.
- ^ Stengl, V; Bakardjieva, S; Murafa, N. Preparation and photocatalytic activity of rare earth doped TiO2 nanoparticles. Materials Chemistry and Physics. 2009, 114: 217. doi:10.1016/j.matchemphys.2008.09.025.
- ^ Vinod S. Agarwala, G. M. Ugiansky. New methods for corrosion testing of aluminum alloys. ASTM International. 1992: 180. ISBN 0-8031-1435-4.
- ^ Bethencourt, M; Botana, F.J.; Calvino, J.J.; Marcos, M.; Rodríguez-Chacón, M.A. Lanthanide compounds as environmentally-friendly corrosion inhibitors of aluminium alloys: a review. Corrosion Science. 1998, 40 (11): 1803. doi:10.1016/S0010-938X(98)00077-8.
- ^ Takeuchi, M; Kato, T; Hanada, K; Koizumi, T; Aose, S. Corrosion resistance of ceramic materials in pyrochemical reprocessing condition by using molten salt for spent nuclear oxide fuel. Journal of Physics and Chemistry of Solids. 2005, 66 (2–4): 521. doi:10.1016/j.jpcs.2004.06.046.
- ^ Neodymium Chloride. [2009-07-07]. (原始內容存檔於2009-09-04).
- ^ MSDS. [2009-07-07]. (原始內容存檔於2011-07-16).
- ^ Donald E. Garrett. Borates. Academic Press. 1998: 385. ISBN 978-0-12-276060-0.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||