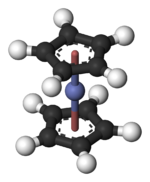
二茂鈷
| 二茂鈷 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Cobaltocene Bis(η5-cyclopentadienyl)cobalt | |||
| 別名 | Cp2Co | ||
| 識別 | |||
| CAS編號 | 1277-43-6 | ||
| PubChem | 22045960 | ||
| ChemSpider | 83848 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ILZSSCVGGYJLOG-UHFFFAOYAM | ||
| ChEBI | 30678 | ||
| RTECS | GG0350000 | ||
| 性質 | |||
| 化學式 | [Co(η5-C5H5)2] | ||
| 莫耳質量 | 189.12 g·mol⁻¹ | ||
| 外觀 | 暗紫色固體 | ||
| 熔點 | 171~173℃ | ||
| 溶解性(水) | 難溶 | ||
| 結構 | |||
| 配位幾何 | 夾心 | ||
| 偶極矩 | 零 | ||
| 熱力學 | |||
| ΔfHm⦵298K | +237 kJ/mol (推算) | ||
| ΔcHm⦵ | −5839 kJ/mol | ||
| S⦵298K | 236 J K−1 mol−1 | ||
| 危險性 | |||
| 警示術語 | R:R10, R36/37/38 | ||
| 安全術語 | S:S9, S16, S26, S33, S37/39 | ||
| 歐盟分類 | |||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化合物 | Ferrocene Nickelocene Rhodocene | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
二茂鈷(又稱雙環戊二烯合鈷)是一種有機鈷化合物,化學式為Co(C5H5)2。它是暗紫色固體,在略高於室溫的溫度下迅速升華。二茂鈷在二茂鐵之後被發現,由於易被氧化,因此使用或儲存時,必須隔絕空氣。
二茂鈷難溶於水、液氨,可溶於有機溶劑,形成紫紅色溶液。[1]
製備[編輯]
二茂鈷可以由環戊二烯基鈉和無水氯化鈷在四氫呋喃中反應得到(放熱反應[1]),產物通過真空升華提純:[2]
- 2 CpNa + CoCl2 → CoCp2 + 2 NaCl
結構[編輯]
在Co(C5H5)2中,中心Co原子夾心在環戊二烯基之間。其中的Co–C鍵長約為2.1 Å,略長於二茂鐵的Fe–C鍵。[3]
Co(C5H5)2屬於茂金屬或夾心化合物[4],有著19個價電子,比通常在過渡金屬有機錯合物中的多一個。額外的電子占據Co–C鍵的一個反鍵軌域。因此,Co–C的鍵長略長於二茂鐵中的Fe–C鍵。由於這個額外的電子,Co(C5H5)2十分容易在化學反應中失去一個電子,達到18電子的穩定結構,形成二茂鈷陽離子:
而同族的二茂銠不以單體的形式存在,而是通過環戊二烯環之間的C–C鍵二聚。
反應[編輯]
氧化還原反應[編輯]
Co(C5H5)2是實驗室中常見的單電子還原劑。[5]實際上,Co(C5H5)2氧化還原電對的可逆性較好,可用於循環伏安法的內標。它的全甲基化的類似物Co(C5Me5)2是一種強還原劑,這是來自分子中10個甲基的給電子誘導效應,有利於讓該錯合物在反應中失去電子。這些化合物的還原電位在下表中列出,以二茂鐵為參考:
| 半反應 | E0 (V) |
|---|---|
| Fe(C 5H 5)+ 2 + e− ⇌ Fe(C5H5)2 |
0 (參照值) |
| Fe(C 5Me 5)+ 2 + e− ⇌ Fe(C5Me5)2 |
−0.59 |
| Co(C 5H 5)+ 2 + e− ⇌ Co(C5H5)2 |
−1.33 |
| Co(C 5Me 5)+ 2 e− ⇌ Co(C5Me5)2 |
−1.94 |
其中,十甲基衍生物的還原電位比母體的要低出約600 mV。這種取代效應受到金屬的掩蔽,Co比Fe對應電位低了1.3 V。
羰基化反應[編輯]
Co(C5H5)2和一氧化碳反應,產生鈷(I)的衍生物二羰基環戊二烯基鈷——Co(C5H5)(CO)2,反應時失去一個Cp配位基。[2]
參考文獻[編輯]
- ^ 1.0 1.1 無機化學叢書 第九卷 錳分族 鐵系 鉑系. 北京:科學出版社. pp 309. π-環戊二烯基錯合物
- ^ 2.0 2.1 King, R. B. Organometallic Syntheses 1. New York, NY: Academic Press. 1965.
- ^ Antipin, M. Yu.; Boese, R.; Augart, N.; Schmid, G. Redetermination of the cobaltocene crystal structure at 100 K and 297 K: Comparison with ferrocene and nickelocene. Struct. Chem. 1993, 4 (2): 91–101. doi:10.1007/BF00677370.
- ^ Elschenbroich, C.; Salzer, A. Organometallics: A Concise Introduction 2nd. Weinheim: Wiley-VCH. 1992. ISBN 3-527-28165-7.
- ^ Connelly, N. G.; Geiger, W. E. Chemical Redox Agents for Organometallic Chemistry. Chem. Rev. 1996, 96 (2): 877–910. PMID 11848774. doi:10.1021/cr940053x.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||