尿素-過氧化氫加合物
| 尿素-過氧化氫加合物 | |||
|---|---|---|---|
| |||

| |||
| 別名 | Hyperol, artizone, 過氧化氫-尿素加合物, UHP | ||
| 識別 | |||
| CAS號 | 124-43-6 | ||
| PubChem | 31294 | ||
| ChemSpider | 29034 | ||
| SMILES |
| ||
| ChEBI | 75178 | ||
| 性質 | |||
| 化學式 | CH6N2O3 | ||
| 摩爾質量 | 94.07 g·mol−1 | ||
| 外觀 | 白色固體 | ||
| 密度 | 1.50 g/cm3 | ||
| 熔點 | 75至91.5 °C(分解) | ||
| 藥理學 | |||
| ATC代碼 | D02AE01(D02) | ||
| 危險性 | |||
GHS危險性符號 
| |||
| GHS提示詞 | 危險 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
尿素-過氧化氫加合物(也可稱為過氧化氫-尿素加合物或UHP)是由等當量的過氧化氫和尿素加合形成的固體。該化合物是一種白色晶體,溶於水後可以產生游離的過氧化氫。尿素-過氧化氫加合物在常溫下為固體,且不含水,在作氧化劑時比液態雙氧水的穩定性和可靠性更高。在牙科領域,尿素-過氧化氫加合物也可稱作過氧化脲,它可以當作過氧化氫的來源來使用,可應用於漂白、消毒和氧化等方面。
製備[編輯]
在低於60℃的溫度下將尿素溶解在30%的過氧化氫溶液中(摩爾比為2:3)。冷卻該溶液時,尿素-過氧化氫加合物即以沉澱形式析出 [1]
用高錳酸鉀滴定尿素-過氧化氫加合物中的過氧化氫時,測得的含量為35.4%,相當於理論最大值的97.8%。過氧化氫有效含量偏低的原因是按這種方法製備的尿素-過氧化氫加合物中會含有少量的尿素雜質。
與結晶水相似,過氧化氫與尿素以 1:1的計量比共結晶。工業上通過將尿素溶解在過量的濃過氧化氫溶液中再結晶來生產尿素-過氧化氫加合物(年產量在百噸量級)。實驗室的製備方法也與之類似。 [2]
結構和性質[編輯]
過氧化氫-尿素加合物是一種易溶於水,無味的晶體,通常為白色粉末、無色針狀或片狀固體。 [1]當尿素-過氧化氫加合物溶解後會分解成尿素和過氧化氫。因此,尿素-過氧化氫加合物是一種與過氧化氫性質相似的氧化劑。然而,室溫下,尿素-過氧化氫加合物可以在催化劑存在下以可控的速率釋放過氧化氫,因此,該化合物適合作為過氧化氫的安全替代品。尿素-過氧化氫加合物在高於 82 °C時會加速分解 [4],因此在使用尿素-過氧化氫加合物時,不應將其加熱到 60 °C以上(尤其是純淨的尿素-過氧化氫加合物)。
商業尿素-過氧化氫加合物樣品的溶解度從 0.05 g/mL [5]到超過 0.6 g/mL 不等。 [6]
應用[編輯]
消毒劑和漂白劑[編輯]
尿素-過氧化氫加合物常用作化妝品和藥品中的消毒漂白劑。 這種化合物還可用於製備牙齒美白製劑。 [7] 它還可以用於緩解牙齦、口腔黏膜表面和嘴唇的輕微炎症,包括口腔潰瘍和牙齒刺激,並且還可以乳化、分散耳垢。 [8]
尿素-過氧化氫加合物也用作隱形眼鏡的消毒劑,或在漱口水、滴耳劑或表面傷口和潰瘍的消毒劑中作消毒的有效成分。
有機合成試劑[編輯]
在實驗室中,尿素-過氧化氫加合物可用替代過氧化氫使用,由於它更容易處理,因此在實驗室應用中較過氧化氫方便。 [2] [9] [10]尿素-過氧化氫加合物的反應性可以通過選擇合適的反應條件控制,它是一種穩定、易於處理的有效氧化劑。尿素-過氧化氫加合物可以以環保的方式提供氧化產物,並且通常產率較高,尤其是在存在有機催化劑(如順丁烯二酸酐[11] 或無機催化劑(如鎢酸鈉)的情況下,使用尿素-過氧化氫加合物進行氧化可以高產率地得到氧化產物。 [12]

尿素-過氧化氫加合物可選擇性氧化硫醇產生二硫鍵, [11]還可以將仲醇轉化為酮, [12]硫化物轉化為亞碸和碸, [13]腈轉化為醯胺, [13] N-雜環轉化為氧化胺。 [13] [14]

尿素-過氧化氫加合物可以將羥基苯甲醛轉化為苯二酚( Dakin 反應) [13] [15] 也可以在合適的條件下得到相應的苯甲酸衍生物。 [15]
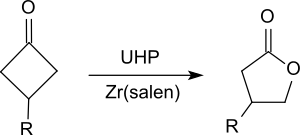
尿素-過氧化氫加合物可將酮氧化為酯(特別是環酮),例如氧化環己酮[16]、環丁酮的衍生物[17]產生內酯( Baeyer-Villiger 氧化)。
在苯甲腈存在下,尿素-過氧化氫加合物可以對各種烯烴環氧化,產生環氧乙烷,產率為 79% 至 96%。 [18]
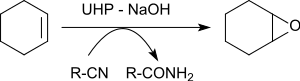
轉移到烯烴上的氧原子來自苄腈中間形成的過氧亞胺酸。過氧亞胺酸被還原後所得的亞胺酸互變異構為苯甲醯胺。
安全[編輯]
尿素-過氧化氫加合物是強氧化劑,可能引起皮膚刺激和嚴重的眼部損傷。[19]它也是不敏感的高爆藥,可在強烈衝擊下爆炸。[20][21]
參見[編輯]
參考文獻[編輯]
- ^ 1.0 1.1 C.-S. Lu, E.W. Hughes, P.A. Giguère, The crystal structure of the urea-hydrogen peroxide addition compound CO(NH2)2 H2O2, J. Am. Chem. Soc., 1941, 63 (6): 1507–1513, doi:10.1021/ja01851a007
- ^ 2.0 2.1 Yu, Lei; Meng, Bo; Huang, Xian. Urea-Hydrogen Peroxide Complex: A Selective Oxidant in the Synthesis of 2-Phenylselenyl-1,3-butadienes. Synthetic Communications. 2008, 38 (18): 3142. doi:10.1080/00397910802109224.
- ^ Fritchie, Jr., C. J.; McMullan, R. K. Neutron Diffraction Study of the 1:1 Urea:Hydrogen Peroxide complex at 81 K. Acta Crystallographica Section B. 1981, 37 (5): 1086. doi:10.1107/S0567740881005116.
- ^ H. Heaney, F. Cardona, A. Goti, A.L. Frederick. Encyclopedia of Reagents for Organic Synthesis. 2013. ISBN 978-0471936237. doi:10.1002/047084289X.rh047.pub3.
- ^ Sigma-Aldrich specification sheet. [2022-01-06]. (原始內容存檔於2016-01-15).
- ^ Chemicalland data sheet. [2022-01-06]. (原始內容存檔於2010-07-28).
- ^ Mokhlis, G. R.; Matis, B. A.; Cochran, M. A.; Eckert, G. J. A Clinical Evaluation of Carbamide Peroxide and Hydrogen Peroxide Whitening Agents during Daytime Use. Journal of the American Dental Association. 2000, 131 (9): 1269–77. PMID 10986827. doi:10.14219/jada.archive.2000.0380. (原始內容存檔於2013-02-23).
- ^ Ear Drops GENERIC NAME(S): CARBAMIDE PEROXIDE. WebMD. [July 3, 2021]. (原始內容存檔於2021-07-09).
- ^ Varma, Rajender S.; Naicker, Kannan P. The Urea−Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles. Organic Letters. 1999, 1 (2): 189. doi:10.1021/ol990522n.
- ^ Harry Heaney, Francesca Cardona, Andrea Goti, "Hydrogen Peroxide–Urea" Encyclopedia of Reagents for Organic Synthesis 2008. doi:10.1002/047084289X.rh047.pub2
- ^ 11.0 11.1 B. Karami, M. Montazerozohori, M. H. Habibi, Urea-Hydrogen Peroxide (UHP) oxidation of thiols to the corresponding disulfides promoted by maleic anhydride as mediator (PDF), Molecules, 2005, 10 (10): 1358–1363 [2022-01-06], PMC 6147623
 , PMID 18007530, doi:10.3390/10101385, (原始內容 (PDF)存檔於2021-10-29) (德語)
, PMID 18007530, doi:10.3390/10101385, (原始內容 (PDF)存檔於2021-10-29) (德語)
- ^ 12.0 12.1 J. Pielichowski. Microwave-assisted oxidation of alcohols using urea hydrogen peroxide. [2016-05-10]. (原始內容存檔於2019-01-29) (英語).
- ^ 13.0 13.1 13.2 13.3 R.S. Varma, K.P. Naicker, The Urea-Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles, Org. Lett.: 189–191, doi:10.1021/ol990522n (德語)
- ^ D. Rong, V.A. Phillips, R.S. Rubio, M.A. Castro, R.T. Wheelhouse, A safe, convenient and efficient method for the preparation of heterocyclic N-oxides using urea-hydrogen peroxide, Tetrahedron Lett.: 6933–6935, doi:10.1016/j.tetlet.2008.09.124 (德語)
- ^ 15.0 15.1 H. Heaney, A.J. Newbold, The oxidation of aromatic aldehydes by magnesium monoperoxyphthalate and urea-hydrogen peroxide, Tetrahedron Lett., 2001, 42 (37): 6607–6609, doi:10.1016/S0040-4039(01)01332-6 (德語)
- ^ M.Y. Rios, E. Salazar, H.F. Olivo, Baeyer–Villiger oxidation of substituted cyclohexanones via lipase-mediated perhydrolysis utilizing urea–hydrogen peroxide in ethyl acetate, Green Chem., 2007, 9 (5): 459–462, doi:10.1039/B618175A (德語)
- ^ A. Watanabe, T. Uchida, K. Ito, T. Katsuki, Highly enantioselective Baeyer-Villiger oxidation using Zr(salen) complex as catalyst, Tetrahedron Lett., 2002, 43 (25): 4481–4485, doi:10.1016/S0040-4039(02)00831-6 (德語)
- ^ L. Ji, Y.-N. Wang, C. Qian, X.-Z. Chen, Nitrile-promoted alkene epoxidation with urea-hydrogen peroxide (UHP), Synth. Commun., 2013, 43 (16): 2256–2264, doi:10.1080/00397911.2012.699578 (德語)
- ^ Hydrogen peroxide urea SDS. merckmillipore.com. 16 May 2023 [2023-12-17]. (原始內容存檔於2023-06-21).
- ^ Halleux, Francis; Pons, Jean‐François; Wilson, Ian; Van Riet, Romuald; Lefebvre, Michel. Small-Scale Detonation of Industrial Urea-Hydrogen Peroxide (UHP). Propellants, Explosives, Pyrotechnics. 2022, 47 (2) [2023-12-17]. S2CID 244899815. doi:10.1002/prep.202100250. hdl:1826/17469. (原始內容存檔於2023-09-12).
- ^ Halleux, Francis; Pons, Jean‐François; Wilson, Ian; Simoens, Bart; Van Riet, Romuald; Lefebvre, Michel. Detonation performance of urea‐hydrogen peroxide (UHP). Propellants, Explosives, Pyrotechnics. 2023, 48 (6). S2CID 257196173. doi:10.1002/prep.202300011.
外部連結[編輯]
- Hydrogen peroxide urea adduct, UHP. Organic Chemistry Portal. [2022-01-06]. (原始內容存檔於2021-10-15).
- Carbamide Peroxide Monograph. Drugs.com. [2022-01-06]. (原始內容存檔於2021-10-15).


